Les propriétés physiques et chimiques du Diamant
Caractéristiques générales du Diamant
Les caractéristiques physiques et chimiques extraordinaires du Diamant sont également à la base de l’intérêt immense pour ce minéral. Le Diamant n’est pas seulement utilisé en bijouterie, qui recherche une bonne pureté et couleur, mais aussi dans quasiment toutes les branches industrielles, comme par exemple pour les firmes pétrolières (porte foret en diamant), des scies à béton, des scalpels chirurgicaux et des applications dans les domaines « high-tech » comme les ordinateurs.
|
Chemical composition |
hardness |
density |
Refractive index |
Dispersion |
|
Carbon (C) |
10 (mohs) +/- 9000kg/mm2 |
3.515 g/cm3 +/-0.015 g/cm3 |
2.42 |
0.044 |
- Le Diamant brûle dans un courant d’oxygène pur à partir de +/- 800°C et se transforme en dioxyde de carbone (CO2).
- Le Diamant se graphitise dans l’absence d’oxygène à partir de +/- 1500°C.
- Le Diamant est le matériau à la conductibilité thermique la plus élevée (600-1500 Watt/m Kelvin).
- Le Diamant est le matériau avec le coefficient de dilatation thermique le plus faible (+ /- 0.000001/°C).
- Le Diamant ne se mouille pas dans l’eau. Il a une forte adhérence à la graisse.
- Chimiquement, le Diamant n’est pas attaqué par les acides. Cependant il est attaqué par les sels fondus comme le nitrate de potassium (KNO3)
Caractéristiques chimiques
Comme mentionné précédemment, les liaisons entre les atomes de carbone dans un cristal de Diamant sont les liaisons covalentes les plus fortes du monde chimique. Il faut une énergie énorme pour les briser. Toutes les propriétés physiques du Diamant sont le résultat direct de la structure interne du cristal.
Caractéristiques physiques
La dureté
Il y a plusieurs caractéristiques de matériaux que l’on peut utiliser pour mesurer le degré de dureté. La dureté peut être définie comme la résistance aux rayures, pliages, cassage ou clivage. L’échelle de Mohs, inventée par Mohs en 1822, a été mise au point par le minéralogiste autrichien Friedrich Mohs. Il prit 10 minéraux bien connus et faciles à identifier et les classifia selon leur "résistance aux rayures". Cette échelle comparative simplifiée est basée sur le principe que toute substance d’une dureté donnée peut rayer toute autre substance de moindre dureté et à son tour être rayée par une substance de dureté plus élevée. Par ailleurs, un minéral de dureté identique à un autre peut le rayer ou être rayé par lui.
Le tableau ci-dessous mentionne les minéraux références de l’échelle de Mohs.

Echelle relative de Mohs
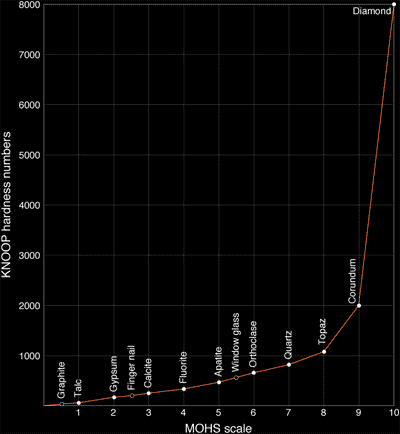
Echelle de Knoop illustrant les différences de force à appliquer pour rayer (à l’aide d’une pointe de Diamant) chacun des dix minéraux de l’échelle de Mohs.
Le Diamant est le minéral le plus Dur qui existe (dureté 10) et peut donc rayer tout autre minéral, mais ne peut être rayé à son tour que par un autre Diamant. Cette dureté exceptionnelle est causée par les liaisons intenses entre les différents atomes de carbone. La dureté dépend de la direction et les faces possédant des liaisons atomiques plus fortes sont les plus dures. Cette extraordinaire dureté du Diamant permet de comprendre pourquoi il est si difficile et complexe de le tailler. Le travail du Diamant n’est possible qu’avec de la poudre ou des déchets de Diamant et seulement en respectant sa structure et le sens de sa cristallisation. Malgré sa dureté extrême, un Diamant reste très fragile (notez la différence entre dureté et solidité). Un coup de marteau peut facilement broyer un cristal de Diamant alors que cela sera plus difficile pour un minéral comme le corindon (rubis, saphir) pourtant moins dur (9).
Densité
La densité ou le poids spécifique d’un corps est le rapport entre son poids et celui d’un volume égal d’eau pure, exprimé en g/cm3. Le poids spécifique du Diamant est 3.52, ce qui rend le Diamant 3.5 fois plus lourd que l’eau (pour un volume égal).
La densité peut être utilisée pour séparer le Diamant de ses imitations. La densité peut être déterminée en mesurant la pierre dans l’eau et dans l’air à l’aide d’une balance précise.
Une autre méthode s’applique par immersion des pierres dans des liquides de densités connues. Une pierre gemme restera en suspension dans un liquide de la même densité, flottera à la surface d’un liquide plus dense et s’enfoncera dans un liquide moins dense.
Conductibilité thermique
Le Diamant est le meilleur conducteur thermique, ce qui signifie que la chaleur est très vite répandue par un Diamant. Même les métaux comme le cuivre et l’argent ont une conductibilité thermique qui est plus basse que celle du diamant.
Dilatation du Diamant
Le coefficient de dilatation du Diamant est un des plus faibles de ceux des corps naturels (+ /- 0.000001/°C).
Le Diamant brûle dans un courant d’oxygène pur à partir de +/- 800°C et se transforme en dioxyde de carbone (CO2). le Diamant se graphitise en l’absence d’oxygène à partir de +/-1500°C.
Conductibilité électrique
Concernant la conductibilité électrique, le Diamant est très bon isolant (à température ambiante), à l’exception de quelques Diamants bleus. Les Diamant bleus présentent des caractéristiques de semi-conducteur en raison de la présence de Bore. Quand on combine ces caractéristiques à celles de la diminution rapide de la chaleur, le Diamant parait parfaitement indiqué pour l’industrie de l’informatique.
Comportement eau-graisse
La densité des atomes de carbone est à la base du comportement étrange du Diamant face à l’eau. Un Diamant ne se mouille pas dans l’eau. Les gouttes glissent à la surface de la pierre. A l’inverse, le Diamant possède une forte adhérence à la graisse. Ces deux caractéristiques sont utilisées lors de l’extraction pour séparer les Diamants des autres minéraux.
Résistance aux acides
Chimiquement, le Diamant n’est pas attaqué par les acides. Cependant il est attaqué par les sels fondus comme le nitrate de potassium (KNO3).
Pour nettoyer un Diamant on peut le faire bouillir dans l’acide sulfurique ; il restera intact.